Electrodo de vidrio

Un electrodo de vidrio es un electrodo de membrana sólida no cristalina que es selectivo a determinados iones, principalmente a los iones hidronio (H3O+), por lo que habitualmente se usa para la medida del pH de las disoluciones. Este tipo de electrodo selectivo de iones está formado por una membrana de vidrio especial, denominado vidrio Corning que muestra respuesta específica a los iones hidrógeno hasta un pH aproximado de 9, en que la respuesta al pH ya no es lineal y los iones Na+ y otros cationes monovalentes comienzan a dar cierta respuesta. Para aumentar la sensibilidad y sensibilidad a pH superiores, en la actualidad se utilizan formulaciones en que el vidrio, además de contener iones sodio y calcio, contiene otros iones, como bario y litio[1]. Estos electrodos forman una parte importante del instrumental para los análisis químicos y estudios físico-químicos en la práctica moderna.
Historia[editar]
El electrodo de vidrio empezó a estudiarse y utilizarse en el análisis químico mucho antes de tener un conocimiento detallado de cómo funcionan los electrodos selectivos de iones y que se generalizara el uso de estos. A comienzos del siglo XX se descubrió que diferentes tipos de vidrios presentaban cierta sensibilidades a los cambios en la acidez del medio (pH), siendo este hecho posteriormente investigado por otros científicos:
- 1906 - M. Cremer determina que el potencial eléctrico que aparece entre diferentes partes de un fluido ubicado en lados opuestos de una membrana de vidrio es proporcional a la concentración de ácido (concentración de iones hidrógeno).[2]
- 1909 - S. P. L. Sørensen introduce el concepto de pH.
- 1909 - F. Haber y Z. Klemensiewicz publican en enero de 1909 los resultados de su investigación sobre electrodos de vidrio en la primera publicación de The Society of Chemistry de Karlsruhe (The Journal of Physical Chemistry by W. Ostwald and J. H. van 't Hoff) - 1909).[3]
- 1922 - W. S. Hughes demuestra que los vidrios de álcali-silicato son similares a un electrodo de hidrógeno reversible con respecto al H+
.[4]
No obstante, tuvieron que pasar dos décadas para que el electrodo de vidrío empezara a ser utilizado de forma generaliza, convirtiéndose a partir del comienzo de los años treinta del siglo XX, en la manera más adecuada de determinar el pH de las disoluciones, mucho más precisa que los procedimientos químicos utilizados hasta entonces.
Tras su descubrimiento y generalización de su uso, se han realizado múltiples investigaciones relacionadas con este tipo de electrodo. Buena parte de ellas estuvieron dirigidas a estudiar la composición del vidrio y la influencia que ésta tenía en la sensibilidad y en la selectividad de la membrana a los iones hidronio (H3O+) o a otros iones monovalentes. En la actualidad existe una gran variedad de formulaciones, siendo el vidrio Corning 015 uno de los más utilizados en la fabricación de membranas para la medida del pH, la aplicación más habitual de este tipo de electrodo.[1]
Construcción[editar]
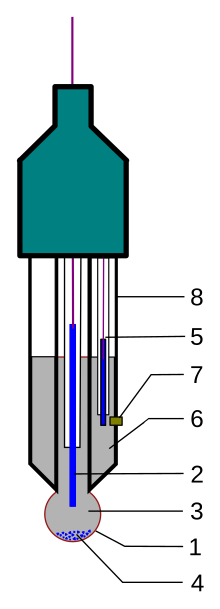
Aunque a veces se utilizan electrodos de vidrio simples, cada vez es más frecuente el empleo de sondas de medición de pH que contienen tanto el electrodo indicador de vidrio junto con el electrodo de referencia. Estas sondas reciben habitualmente el nombre de electrodos combinados de vidrio. Básicamente son dos cilindros de cristal o de otro material, colocados concéntricamente. El tubo central, el más estrecho, se cierra mediante la membrana de vidrio sensible a pH, que generalmente tiene forma de burbuja. Junto a este cilindro, dentro de la cavidad externa se coloca el electrodo de referencia externo, generalmente de Ag/ClAg, aunque ocasionalmente puede ser de calomelanos. El empleo de estas sondas combinadas es más simple y cómoda en su manejo que los sistemas dobles de electrodo de vidrio y de referencia por separado. Estas sondas se fabrican en diferentes formas y tamaños, con la intención de que pueden ser utilizadas en multitud de situaciones diferentes que pueden presentarse tanto a nivel industrial como en el laboratorio.
A continuación se indica, con mayor detalle, la estructura y composición del electrodo combinado:
- La parte sensitiva del electrodo, una membrana, generalmente fabricada con vidrio Corning 015, con forma de burbuja. Presenta una resistividad al paso de la corriente de unos 100 MΩ (no puede ser totalmente aislante)
- Un electrodo de referencia interna, por lo general un electrodo de plata/cloruro de plata o, menos frecuentemente, un electrodo de calomelanos saturado.
- Una solución interna de KCl 0,1 molar para electrodos de pH. En los casos de que este electrodo se modifica para la determinación de otros iones monovalentes, la disolución interna se sustituye por el cloruro de ion metálico a medir, también en concentración 0,1 M.
- Cuando se utiliza un electrodo de cloruro de plata, una pequeña cantidad de AgCl puede precipitar en el interior del electrodo de vidrio.
- Un electrodo de referencia, por lo general también de Ag/AgCl.
- Una solución de referencia interna, por lo general 0,1 mol/l KCl
- Unión con la solución estudiada, por lo general hecha de cerámica, o un capilar relleno de fibra de asbestos o fibra de cuarzo.
- El cuerpo del electrodo que contiene el electrodo de trabajo y el de referencia, hecho de otros tipos de vidrio, generalmente vidrio borosilicato o similar, que no tiene sensibilidad por los hidrogeniones, o de plástico.
Respecto a la membrana de vidrio del electrodo, suele utilizarse vidrio Corning 015, aunque también se han estudiado y probado otras composiciones. La de este tipo de vidrio está formada por aproximadamente 22% de Na2O, 6% de CaO y 72% de SiO2[1]. Este vidrio a pH fuertemente alcalinos, por encima de pH 9 muestra también sensibilidad a los iones sodio, por lo que, si estos se encuentran en determinadas concentraciones, el electrodo produce respuesta erróneas. Este efecto puede minimizarse si en la fabricación de la membrana se sustituye parte de sodio y del calcio de la composición, por bario y litio, con lo que se consiguen membranas con respuesta lineal hasta pH próximo a 11.
Representación esquemática de celda galvánica[editar]
El electrodo de vidrio, como la mayoría de los electrodos selectivos de iones (ISE); actúan de forma similar a como lo hace una semicelda galvánica, es decir, el potencial de semicelda esta relacionado con la concentración del ion al que es sensible, mediante la ecuación de Nerst.
donde el término Cte corresponde a la suma de potenciales del sistema, como el potencial normal de semicelda, el potencial de unión líquida, la variación del potencial en la interfase entre el electrodo y la capa interna de la membrana, entre otros; pero que se mantiene constante mientras no se modifiquen las condiciones de trabajo[5]. Como parte de una celda galvánica, al conectar esta semicelda con la semicelda que actúa como electrodo de referencia, el milivoltímetro al que ambas están conectadas, dará una lectura que será la diferencia de potencial existente entre las dos semiceldas. Sin embargo, esta lectura variará en función de la concentración (o más correctamente, de la actividad) de iones H+ presentes en la disolución de medida. En la actualidad, es muy corriente fabricar los electrodos de vidrio para medida de pH como sondas que reciben el nombre electrodos combinados de vidrio y que básicamente son miniceldas galvánicas que pueden se representadas mediante el siguiente diagrama, de acuerdo con las convenciones simplificadas de barras[6]:
| Ag(s) | AgCl(s) | Cl-(s) || H+(aq) (exterior membrana) | H+(aq) (interior membrana), Cl-(aq) | AgCl(s) | Ag(s) | |||
| Electrodo de referencia | Disolución de medida del pH | Disolución interna del electrodo | Electrodo de ref. interno |
La parte del electrodo que responde a las variaciones de pH es la fina membrana de vidrio, en forma de burbuja, que se coloca en la parte inferior de la sonda. La membrana esta fabricada en un vidrio especial (Corning 015 o similar) que se caracteriza por presentar ligera conductividad eléctrica (unos 100 MΩ, si se expresa como resistividad). Este vidrio, tiene la peculiaridad de que, además de los tres enlaces Si-O característicos del vidrio de silicato, cada silicio se enlaza a un átomo de oxígeno adicional, formando una red irregular con oxígenos cargados negativamente. Estos oxígenos pueden coordinarse con algunos cationes metálicos, si tienen el tamaño adecuado. Los cationes pequeños, especialmente Na+ tienen cierta posibilidad de desplazarse a través de la membrana. Para que esta movilidad pueda darse y los iones puedan moverse desde el interior de la red cristalina hacia la disolución interior o hacia la exterior, es necesario que la membrana se encuentre hidratada. En estas condiciones se producen procesos de intercambio iónico entre el H+ de las disoluciones interior y exterior con el ion Na+ , que es el que transporta las cargas a través de la membrana. Esta carga transportada depende de la diferencia de concentraciones del H+ entre el interior del electrodo y la disolución exterior donde se mide el pH, lo que produce una diferencia de potencia entre ambas caras de la membrana. Esta diferencia de potencial recibe el nombre de potencial de membrana y es el factor que provoca un cambio en la variación de la respuesta del electrodo a los cambios de pH, ya que la concentración de H+ en el interior de la sonda se mantiene constante, así como los potenciales de los electrodos interno y externo de referencia[6].
Todos los electrodos de pH poseen una resistencia eléctrica extremadamente elevada, del orden de entre los 50 y 500 MΩ (típicamente 100 MΩ), por lo tanto, los electrodos de vidrio solo pueden ser utilizados con instrumentos de medición con una muy alta impedancia de entrada, tales como un pH-metro, o, más genéricamente, un voltímetro de alta impedancia de entrada, los cuales suelen ser llamados electrómetros.
Rango de un electrodo de vidrio para pH[editar]

El rango de pH a concentración constante puede ser dividido en tres partes:
- Cumplimiento completo de la función general de electrodo, donde el potencial depende linealmente del pH, comportándose como un electrodo selectivo de ion para hidronio.
Donde F es la constante de Faraday (véase ecuación de Nernst).
- Rango de error alcalino - a bajas concentraciones de iones hidrógeno (altos valores de pH), las contribuciones de los metales interferentes tales como Li, Na, K, son comparables en magnitud a las producidas por los iones hidrógeno. En realidad, todos los cationes monocargados inducen un error alcalino, cuya magnitud depende del catión en cuestión, como de la composición de la membrana de vidrio[1]. En esta situación la dependencia del potencial con respecto al pH se vuelve no lineal. El efecto por lo general ya es notable a pH 12, y a concentraciones de litio o sodio de 0,1 mol/l o mayores. Los iones potasio por lo general provocan menos errores que los iones sodio.
- Rango de error ácido - a concentraciones muy altas de iones hidrógeno, la dependencia del electrodo con respecto al pH se convierte en no lineal, y la influencia de los aniones presentes en la solución comienza a ser notable. Estos efectos, por lo general, comienzan a notarse a pH inferiores a 0,5. La magnitud del error ácido depende de una gran diversidad de factores, no todos bien conocidos y estudiados. Una de las causas más probables es el efecto de saturación de la membrana de vidrio, al encontrarse la mayor parte de la superficie ocupada por iones H+ de la disolución de medida. Como consecuencia, pequeños cambios en el pH, apenas son detectados.
Hay diferentes tipos de electrodos de vidrio, algunos de ellos poseen características mejoradas para trabajar en medios alcalinos o ácidos. Pero la mayor parte de los electrodos poseen las propiedades necesarias para funcionar en los rangos de pH que van entre pH=2 y pH=12. Se pueden utilizar electrodos especiales para trabajo en condiciones especialmente agresivas.
La mayor parte de lo anteriormente escrito es también correcto para cualquier otro electrodo de intercambio de iones.
Aplicaciones[editar]
Los electrodos de vidrio se utilizan por lo general para medir pH, siendo esta su principal utilidad. Sin embargo, el error alcalino descubierto ya con los primeros electrodos, llevó a múltiples investigaciones relacionadas con la influencia que sobre este error pudiera tener la composición de la membrana. Una consecuencia importante derivada de estos estudios fue que determinadas composiciones del vidrio de la membrana permitían determinar cationes diferentes a H+, sobre todo a contracciones bajas de dicho ion, es decir, a pH muy alcalinos. La presencia de Al2O3 o B2O3 en la composición de la membrana de vidrio, permite la medición potenciométrica de numerosas especies catiónicas de una sola carga. Algunas composiciones muestran respuesta selectiva que permite la determinación de litio, sodio, amonio, y otros cationes monovalentes en determinados rangos de concentración de tales cationes.
Los electrodos de vidrio han sido utilizados en un amplio rango de aplicaciones, desde la investigación básica y control de procesos industriales; hasta el análisis de alimentos, cosméticos y comparación de indicadores del medio ambiente; microelectrodos para la medición de los potenciales de membrana de una célula, análisis de la acidez del suelo, etc.
Tipos[editar]
Casi todos los electrodos comerciales responden a iones con una carga simple, tales como H+
, Na+
, Agl+
. El más común de los electrodos de vidrio, es el electrodo de pH. Muy pocos vidrios de calcogenuro son sensibles a los iones con doble carga, tales como el Pb2+
, Cd2+
y algunos otros iones.
Hay dos tipos principales de sistemas para la fabricación de vidrios:
- Silicato, donde la matriz está basada en una red molecular de dióxido de silicio (SiO
2) con la adición de algunos otros óxidos de metales tales como Na, K, Li, Al, B, Ca, etc.
- Calcogenuro la matriz se encuentra basada en una red molecular de AsS, AsSe, AsTe.
Iones interferentes[editar]

Debido a la naturaleza de la membrana de vidrio, de funcionar intercambiando iones, es posible que algunos otros iones interactúen concurrentemente con los centros de intercambio iónico del vidrio distorsionando la dependencia lineal del electrodo de medición con respecto al ion que está siendo medido. En algunos casos es posible incluso cambiar la función del electrodo de un ion por otro. Por ejemplo, algunos electrodos de silicato para la medición de pNa, pueden ser convertidos en electrodos de pAg sumergiéndolos en una solución de una sal de plata.
Los efectos de interferencia por lo general se describen sobre la base de la semiempírica ecuación de Nicolsky-Eisenman,[7] la cual es una extensión de la ecuación de Nernst. Esta ecuación se encuentra dada por:
Donde E es la fem, E0 el potencial estándar de electrodo, z la valencia iónica incluyendo el signo, a la actividad, i el ion de interés, j los iones interferentes, y kij el coeficiente de selectividad. Cuanto menor sea el coeficiente de selectividad, menor es la interferencia producida por j.
Par ver el efecto de interferencia del Na+
en un electrodo de pH:
Almacenamiento[editar]
Entre mediciones cualquier electrodo de vidrio o de membrana debe mantenerse en una solución de su propio ion. Por ejemplo un electrodo de vidrio debe mantenerse en una solución 0,1 mol/l de HCl o 0,1 mol/l de H
2SO
4. Esto es necesario para evitar que la membrana de vidrio se deshidrate
Referencias[editar]
- ↑ a b c d Skoog, D. A.; Holler, F. J.; . Crouch, S. R. (2008). «23D.3 El electrodo de vidrio para medir pH». Principios de análisis instrumental. Mexico: Cengage Learning. pp. 665-671. ISBN 607-481-390-6.
- ↑ Cremer, M. Über die Ursache der elektromotorischen Eigenschaften der Gewebe, zugleich ein Beitrag zur Lehre von Polyphasischen Elektrolytketten. — Z. Biol. 47: 56 (1906).
- ↑ F. Haber und Z. Klemensiewicz. Über elektrische Phasengrenzkräft. Zeitschrift für Physikalische Chemie. Leipzig. 1909 (Vorgetragen in der Sitzung der Karlsruher chemischen Gesellschaft am 28. Jan. 1909).
- ↑ W. S. Hughes, J. Am. Chem. Soc., 44, 2860. 1922; J. Chem. Soc. Lond., 491, 2860. 1928
- ↑ Sánchez Batanero, Pedro (1981). Química Electroanalítica. Fundamentos y aplicaciones. Madrid: Alhambra. pp. 194-195. ISBN 84-205-0824-1.
- ↑ a b Harris, Daniel C. (1992). «Cap.15-5 Medición del pH con un electrodo de vidrio». Análisis Químico Cuantitativo. Grupo Editorial Iberoamericana. ISBN 970-625-003-4.
- ↑ D. G. Hall, Ion-Selective Membrane Electrodes: A General Limiting Treatment of Interference Effects, J. Phys. Chem 100, 7230 - 7236 (1996) article

![{\displaystyle E=Cte+{\frac {0,059}{n}}\log[H_{3}O^{+}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/906d483396f84205967be6c4160964b01c48e945)

![{\displaystyle E=E^{0}+{\frac {RT}{z_{i}F}}\ln \left[a_{i}+\sum _{j}\left(k_{ij}a_{j}^{z_{i}/z_{j}}\right)\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/173a9dcfbed1bd62faa8126ce218e846c1aabc03)
